Article contents
The stability, free energy and heat of formation of imogolite
Published online by Cambridge University Press: 09 July 2018
Abstract
From equilibrium silica concentrations over imogolite and boehmite at 100–155°C, the heat and free energy of the reaction (HO)3Al2O3SiOH + H2O ⇌ 2AlOOH + Si(OH)4 have been obtained: ΔH°r (298·15 K)=38·6 ± 4·1, ΔG°r (298·15 K) = 26.8 ± 1·1 kJ mol−1, and hence the heat and free energy of formation of imogolite: ΔH°f (298·15 K) = −3189·6 ± 4·1, ΔG°f (298·15 K) = − 2926·7 ± 1·1 kJ mol−1 These results are consistent with observations indicating that imogolite, halloysite and gibbsite can co-exist in soils, but that imogolite is metastable relative to either halloysite or gibbsite in the long term. At temperatures above 25°C there is a widening range of silica concentrations in which imogolite is more stable than halloysite, although both are metastable relative to kaolinite.
Résumé
A partir des concentrations d'équilibre de la silice dans l'imogolite et la boehmite à 100–155°C, On a obtenu la chaleur et l'énergie libre de la réaction 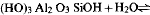
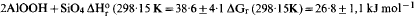 , d'où on tire la chaleur et l'énergie libre de formation de l'imogolite: ΔH°r (298·15 K)=38·6 ± 4·1, ΔG°r (298·15 K) = 26.8 ± 1·1 kJ mol−1, ΔGf (298·15 K= −2926·7 ± 1·1 kJ mol−1 Ces résultats sont en accord avec des observations indiquant que l'imogolite, l'halloysite et la gibbsite peuvent coexister dans les sols, mais qu'à long terme l'imogolite est métastable par rapport à l'halloysite ou à la gibbsite. Aux températures supérieures à 25°C, il apparait un élargissement de la gamme des concentrations en silice pour lesquelles l'imogolite est plus stable que l'halloysite, bien que toutes deux soient métastables par rapport à la kaolinite.
, d'où on tire la chaleur et l'énergie libre de formation de l'imogolite: ΔH°r (298·15 K)=38·6 ± 4·1, ΔG°r (298·15 K) = 26.8 ± 1·1 kJ mol−1, ΔGf (298·15 K= −2926·7 ± 1·1 kJ mol−1 Ces résultats sont en accord avec des observations indiquant que l'imogolite, l'halloysite et la gibbsite peuvent coexister dans les sols, mais qu'à long terme l'imogolite est métastable par rapport à l'halloysite ou à la gibbsite. Aux températures supérieures à 25°C, il apparait un élargissement de la gamme des concentrations en silice pour lesquelles l'imogolite est plus stable que l'halloysite, bien que toutes deux soient métastables par rapport à la kaolinite.
Kurzreferat
Aus Gleichgewichts-Kieselsäurekonzentrationen über Imogolit und Böhmit bei 100–155°C wurde die Reaktionswärme und die freie Energie folgender Reaktion erhalten: (HO)3Al2O3SiOH + H2O ⇌ 2AlOOH + Si(OH)4, ΔH°r (298·15 K)=38·6 ± 4·1, ΔG°r (298·15 K) = 26.8 ± 1·1 kJ mol−1 und araus die Bildungswärme und freie Energie von Imogolit: ΔH°f (298·15 K) = −3189·6 ± 4·1, ΔG°f (298·15 K) = − 2926·7 ± 1·1 kJ mol−1. Diese Ergebnisse sind in Übereinstimmung mit Beobachtungen, die anzeigen, daß Imogolit, Halloysit und Gibbsit in Böden koexistieren können, aber daß auf lange Zeit bezogen Imogolit entweder gegenüber Halloysit oder Gibbsit metastabil ist. Bei Temperaturen über 25°C existiert ein weiter Bereich von Kieselsäurekonzentrationen, in welchen Imogolit stabiler ist als Halloysit, obgleich beide gegenüber Kaolinit metastabil sind.
Resumen
Partiendo de concentraciones de equilibrio de sílice sobre imogolita y boehmita a 100–155°C se han obtenido el calory la energía libre de la reacción (HO)3Al2O3SiOH + H2O ⇌ 2AlOOH + Si(OH)4: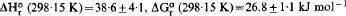 , y por tanto el calor y la energía libre de la formación de imogolita: ΔH°f (298·15 K) = −3189·6 ± 4·1, ΔG°f (298·15 K) = − 2926·7 ± 1·1 kJ mol−1. Estos resultados son consecuentes con las observaciones que indican que la imogolita, la haloisita y la gibbsita pueden coexistir en los suelos, pero que la imogolita es metaestable con relación a la haloisita o la gibbsita a largo plazo. A temperaturas de más de 25°C hay una gama creciente de concentraciones de sílice en las que la imogolita es más estable que la haloisita, aunque ambas son metaestables respecto a la caolinita.
, y por tanto el calor y la energía libre de la formación de imogolita: ΔH°f (298·15 K) = −3189·6 ± 4·1, ΔG°f (298·15 K) = − 2926·7 ± 1·1 kJ mol−1. Estos resultados son consecuentes con las observaciones que indican que la imogolita, la haloisita y la gibbsita pueden coexistir en los suelos, pero que la imogolita es metaestable con relación a la haloisita o la gibbsita a largo plazo. A temperaturas de más de 25°C hay una gama creciente de concentraciones de sílice en las que la imogolita es más estable que la haloisita, aunque ambas son metaestables respecto a la caolinita.
- Type
- Research Article
- Information
- Copyright
- Copyright © The Mineralogical Society of Great Britain and Ireland 1979
References
- 42
- Cited by


